Георгиев Г. Противоопухолевые лекарства: новый подход
Основная проблема лекарственного лечения онкологических заболеваний с использованием химио-, радио-, фотодинамической терапии или же других методов - серьезные побочные эффекты, от которых страдает больной. Все наши воздействия на раковые клетки, к несчастью, распространяются и на здоровые, интенсивно делящиеся и обладающие с ними общими свойствами. Задача ученых - повысить селективность используемых препаратов. Добиться этого позволит доставка их в трансформированные клетки посредством многомодульных носителей.
ЛЕЧЕБНЫЙ ЭФФЕКТ СВЕТА
В последние 20 лет в онкологии все чаще применяют методы диагностики и лечения рака, основанные на современных достижениях фотохимии, фотобиологии, ядерной физики и химии. Один из перспективных подходов — фотодинамическая терапия (ФДТ), при которой накопленное в опухоли лекарство-фотосенсибилизатор уничтожает ее, поглощая облучающий свет. Собственно фотосенсибилизатор для злокачественного новообразования нетоксичен, но опасны образующиеся при его освещении в присутствии О2 так называемые активные формы кислорода (АФК): синглетный кислород ( 02), гидроксильный радикал (ОН) и другие, мишенями для которых в клетке служат многие молекулы (белки, липиды, нуклеиновые кислоты) и образуемые ими надмолекулярные структуры. В результате сложной последовательности фотохимических и фотобиологических процессов происходит необратимое повреждение раковых клеток и/или сосудов опухоли.
Как нередко бывает, идея использования активируемых светом химических соединений для лечения различных заболеваний не нова. Еще в Древнем Египте лечили заболевание кожи — витилиго, применяя растения, содержащие псоралены (Псоралены - природные фотосенсибилизаторы, содержащиеся в экстрактах семян растений семейства зонтичных (Ammi majus L.) и бобовых (Psoralea corylifolia L.), а также их синтетические аналоги (прим. авт.)) и солнечный свет. В новейшее время одна из первых Нобелевских премий (1903 г.) по физиологии и медицине была присуждена датчанину Нильсу Финзену, «вновь открывшему» лечебные эффекты света. И опять последовала относиnельная «пауза», к счастью, длившаяся не тысячи, а десятки лет.
Интерес к ФДТ активно проявился в 70-е годы XX в. — тогда для лечения рака кожи успешно использовали синтезированную Томасом Догерти из Института рака (Россвелл-Парк, США) смесь производных гематопорфирина (Гематопорфирин — пигмент пурпурного цвета, образующийся при действии сильных кислот на гематин, гемин и гемоглобин (прим. авт.)) и с тех пор не только не спадает, но постоянно растет. Вскоре компания QLT PhotoTherapeutics (Ванкувер, Канада) запатентовала препарат фотофрин, представляющий собой очищенную смесь производных гематопорфирина. Однако несмотря на то, что появившееся лекарство довольно эффективно при лечении некоторых видов рака (пищевода, кожи, мочевого пузыря и др.), а также ряда неонкологических заболеваний, у него есть существенный недостаток: фотофрин, как и все последовавшие за ним препараты для ФДТ, неспецифически накапливается в клетках опухоли и очень медленно выводится из организма, что повышает фоточувствительность кожи и сетчатки глаз, и нередко дает тяжелые осложнения.
Каковы причины этих побочных явлений? АФК, генерируемые фотосенсибилизатором при его освещении, «пробегают» в клетках размером 10-20 мк дистанцию в среднем не более 40 нм. Сопоставление названных величин показывает: эффективность лекарства будет зависеть не только от его относительного распределения между опухолью и окружающими тканями — раковыми и нормальными клетками, но и от размещения внутри них.
Важно отметить: чувствительность структурных компонентов клетки к действию АФК различна, причем наибольшей обладает ядро. Но согласно имеющимся на сегодня данным о внутриклеточном распределении фотосенсибилизаторов, они поступают во все органеллы, а в ядра — нет (там их не обнаружили). Следовательно, дм достижения желаемого цитотоксического эффекта необходимо увеличить дозу используемого препарата, что вызывает осложнения и побочные действия, выраженные тем сильнее, чем больше доза.
Здесь стоит сказать, что ни один из фотосенсибилизаторов не обладает сколько-нибудь выраженной специфичностью в отношении каких-либо типов клеток (раковых или сосудов опухоли), и если накапливается в них, то поражает одинаково. Такое «уклонение» лекарства от наиболее уязвимого объекта приводит к мысли о целесообразности поиска модификаций фотосенсибилизаторов, придания им новых свойств, способствующих накоплению в ядрах клеток-мишеней.
Очень важны дальнейшие превращения введенного в организм фотосенсибилизатора. Свободными остаются лишь его агрегированные формы, составляющие не более 1/10 от введенной дозы и далеко не всегда представляющие интерес для терапии, тогда как неатрегированные связываются с различными белками и надмолекулярными комплексами крови. Дальнейшую судьбу этих нековалентных соединений (распределение их по тканям, клеткам и субклеточным компонентам) определяет уже не фотосенсибилизатор, а связывающие его белки. Кроме того, будучи в комплексе с последними, он можег генерировать АФК иначе, чем в свободном состоянии.
И вновь возникает мысль: целесообразно ли при доставке фотосенсибилизаторов в специфические для них клетки полагаться только на белки крови или предопределить дальнейшую судьбу лекарства, связав его (перед введением в организм) с транспортером с заранее заданными свойствами?
Есть и еще одна сторона дела. Ряд фотосенсибилизаторов (например, катионные) после поглощения клеткой и последующего освещения приводят ее к гибели, повреждая митохондрии. Закономерен вопрос: пусть это не самые уязвимые органеллы, но, может быть, стоит ограничиться ими и не усложнять лекарство, добавляя к нему специальный транспортер? К сожалению, этому препятствуют два момента. Прежде всего, митохондрии для упомянутых фотосенсибилизаторов оказываются далеко не единственным и даже не преимущественным местом локализации, что вновь возвращает нас к проблеме повышенных доз. К тому же по-прежнему остается нерешенной задача доставки лекарства в такие клетки-мишени, куда их не транспортируют белки крови.
Нам представляется, что доставка фотосенсибилизаторов в наиболее чувствительные компартменты ютеток-мишеней специальными транспортерами решит указанные проблемы. Целесообразность создания такого механизма для других противоопухолевых веществ — радионуклидов, испускающих альфа-частицы (альфа-эмиттеры), еще очевиднее: уже более 60 лет известно, что ядро представляет собой наиболее уязвимую мишень для этого излучения. Сами же альфа-эмиттеры, как и фотосенсибилизаторы, не обладают специфичностью ни к определенному типу клеток, ни к органеллам.
Здесь следует сказать несколько слов об этих радионуклидах и возникшем за последние годы интересе к ним. Сравнение с излучателями бета-частиц, которые и сейчас являются основным «оружием» при эндорадио-терапии рака, позволяет сделать следующие выводы: альфа-излучение вызывает, во-первых, больше невосстановимых разрывов ДНК, во-вторых, больше хромосомных повреждений и, в-третьих, более продолжительную задержку клеточного деления, чем бета-излучение. В результате их воздействия возникают более серьезные и невосстановимые поражения раковых клеток.
Микродозиметрический расчет показывает: один распад альфа-эмиттера 2llAt на поверхности клетки по своей цитотоксичности эквивалентен 1000 распадам бета-эмитттера 90Y. Эти особенности, а также новые возможности, появившиеся в результате прогресса в области физики ускорителей, радиохимии, биотехнологии и других сферах, повысили интерес онкологов к альфа-эмиттерам. Особенно многообещающей представляется эндорадиотерапия опухолей головного мозга (лечение глиобластомы ( Глиобластома — разновидность злокачественной опухоли центральной нервной системы (прим. авт.)) в медицинском центре Университета Дьюка; Дюрем, Северная Каролина, США) и острого миелобластного лейкоза (Миелобластный лейкоз — разновидность злокачественного поражения кроветворных органов (прим. авт.)) (Мемориальный онкологический центр Слоан Кеттеринг, Нью-Йорк, США). Однако пока лучшее, чего удается достичь, - это доставка альфа-эмиттеров к раковым клеткам-мишеням (обычно с помощью антител), чьи ядра они должны поразить, испуская альфа-частицы. При этом эффективной оказывается далеко не каждая из них. Следовательно, целесообразно создать средства транспортировки этих радионуклидов прямо в ядра клеток-мишеней, что гарантирует требуемый результат.
СЛОВО - ГЕННОЙ ИНЖЕНЕРИИ
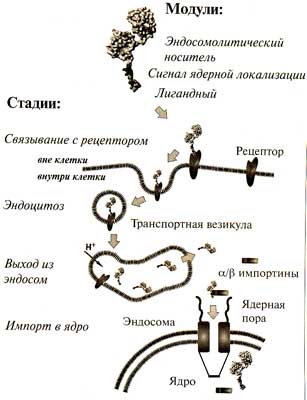
 Такой подход реализовали в Институте биологии гена РАН: здесь создали искусственные мультимодульные нанобелки (ИММНБ) для доставки повреждающих агентов, в том числе фотосенсибилизаторов и альфа-эмиттеров точно к месту назначения. ИММНБ должны «узнать» клетку-мишень среди огромного множества других, преимущественно здоровых, из которых состоит организм, затем проникнуть в нее и, наконец, попасть в ядро.
Такой подход реализовали в Институте биологии гена РАН: здесь создали искусственные мультимодульные нанобелки (ИММНБ) для доставки повреждающих агентов, в том числе фотосенсибилизаторов и альфа-эмиттеров точно к месту назначения. ИММНБ должны «узнать» клетку-мишень среди огромного множества других, преимущественно здоровых, из которых состоит организм, затем проникнуть в нее и, наконец, попасть в ядро.«Узнавание» межмолекулярное (на субклеточном уровне) означает, что между выбирающими друг друга молекулами образуется комплекс, характеризующийся большими константами сродства (величинами, обратными равновесным константам диссоциации), — не менее 108 л/моль. Проникновения внутрь клетки можно достичь различными способами, но главное - оно должно следовать за «узнаванием», иначе будет утрачена всякая избирательность, и ИММНБ может оказаться не в той клетке.
Поставленная таким образом задача навела на мысль о возможности использования нормального процесса, протекающего и в здоровых, и в раковых клетках, — ре-цептор-опосредуемого эндоцитоза. В ходе его клетка получает извне не только низко- и высокомолекулярные соединения, но и надмолекулярные комплексы, причем это осуществляется очень избирательно, ибо обеспечивается высокоспецифичным связыванием транспортируемого вещества (его обобщенное название «лиганд») с соответствующим рецептором.
Итак, нужно было на основе сопоставления «рецеп-торных портретов» нормальных клеток и раковых клеток-мишеней подобрать лиганд, рецепторы к которому во множестве представлены на вторых, но их мало или вообще нет на первых. Такое вещество было найдено и стало одним из модулей ИММНБ — лигандным.
Однако начав движение, ИММНБ вынужден будет следовать по выбранному пути, находясь внутри эндоцитозных пузырьков и передвигаясь вместе с ними. В итоге он может оказаться в лизосомах, где под действием кислых гидролаз распадется еще до того, как попадет в ядро. Данное обстоятельство диктует необходимость обеспечить его модулем, позволяющим «соскочить» с эндоцитозного пути еще до лизосом. Второе, и не менее значимое основание для этого, состоит в том, что именно вне названных пузырьков находятся клеточные белки, осуществляющие первые этапы доставки ИММНБ в конечный пункт назначения — ядро.
Известно немало макромолекул, способных делать в биологических мембранах отверстия, однако далеко не каждая подойдет в качестве искомого модуля. Например, порообразующие молекулы, эффективные в нейтральной и слабощелочной среде (характерной для крови и тканевых жидкостей), не годятся, поскольку они выполнят свою функцию при первом же контакте с любой клеткой, и желаемая избирательность будет утрачена. Поэтому мы остановили свой выбор на порообразу-ющих молекулах, активных при рН около 5,5-6 (свойственных тем эндоцитозным пузырькам — эндосомам, которые предшествуют лизосомам) и неактивных в нейтральной среде. Они стали эндосомолитическим модулем.
Далее. Для доставки в клеточное ядро можно воспользоваться нормальным процессом цитоплазменно-ядерного транспорта, присущим как раковым, так и нормальным клеткам. Тогда ИММНБ должен обладать модулем, содержащим аминокислотную последовательность (сигнал ядерной локализации), «узнаваемую» особыми белками-импортинами, находящимися в бесструктурной части цитоплазмы. Кроме того, нужен модуль-носитель для присоединения «транспортируемого» лекарства к ИММНБ.
В итоге методами генной инженерии были сконструированы полипептиды, содержащие только те фрагменты известных белков, которые непосредственно выполняют одну из четырех заданных функций: присоединить действующий агент (фотосенсибилизатор или альфа-эмиттер), связаться со специфическим рецептором на поверхности раковой клетки-мишени, проникнуть в цитоплазму, пройти в ядро.
Отметим: ни в одном из природных белков или их комплексов нет совокупности тех функциональных свойств, которые в составе полученной нами небольшой молекулы ИММНБ обеспечивают четыре модуля: лигандный, эндосомолитический, содержащий сигнал ядерной локализации и носитель повреждающего агента (противоопухолевого лекарства).
Как выяснилось, переход на наноуровень сопровождается изменением свойств частиц. Ослабляются имму-ногенные качества, препятствующие терапевтическому использованию, и существенно возрастает эффективность лечения благодаря доступности всех активных групп в ИММНБ и уменьшению размеров. В результате противоопухолевый агент приобретает избирательную токсичность только в отношении клеток заданного типа, причем благодаря проникновению в их ядра эффективность воздействия возрастает в 500-3000 раз.
Новая технология позволила быстро создавать для лекарственных препаратов «транспорт», достигающий раковых клеток разных типов: меланомы, эпидермальной карциномы, глиобластомы, плоскоклеточного рака головы и шеи и т. д. Для смены «мишени» нужно лишь заменить лигандный модуль. Последний можно и перемещать, «перекраивая» ИММНБ для различных целей.
Опыты на животных показали: описываемые вещества делают противоопухолевые лекарства действенными там, где сами по себе они малоэффективны или совсем не могут быть применены — например, при фотодинамической терапии пигментированных опухолей. Доставленные фотосенсибилизаторами непосредственно в ядра их клеток, ИММНБ способны использовать даже небольшое количество проникающего света.
Предложенный модульный и комбинаторный подход к специфически-направленной доставке фотосенсибилизаторов, альфа-эмиттеров и других локально действующих лекарств представляет, по нашему мнению, первый шаг на пути разработки нового поколения фармакологических агентов.
Академик Георгий ГЕОРГИЕВ,
доктор биологических наук Александр СОБОЛЕВ, Институт биологии гена РАН
"Наука в России", № 2, 2007






 Издательство «Свиньин и сыновья» выпустило несколько сотен самых разных по жанру, объему и авторам, но неизменно высококультурных изданий
Издательство «Свиньин и сыновья» выпустило несколько сотен самых разных по жанру, объему и авторам, но неизменно высококультурных изданий





