Угрюмов М. Компенсаторные возможности мозга
До середины XX в. в нейробиологии господствовали представления о консервативности структурно-функциональной организации мозга, т.е. ее неизменности на протяжении жизни человека. Хотя подобные воззрения и противоречили уже накопленному к тому времени массиву экспериментальных и клинических наблюдений, лишь в последние десятилетия устоявшиеся взгляды были пересмотрены. На клеточном и молекулярно-генетическом уровне получены доказательства гигантских компенсаторных возможностей этого уникального органа, его пластичности. Познание их механизмов открывает перспективы разработки новых методов диагностики и лечения социально значимых хронических нейродегенеративных заболеваний, по распространенности занимающих третье место в мире после сердечно-сосудистых и онкологических.
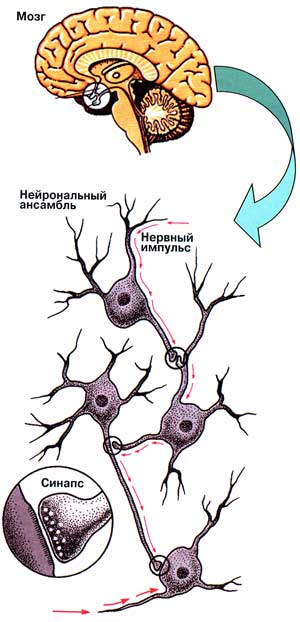
НЕЙРОНЫ И НЕЙРОНАЛЬНЫЕ АНСАМБЛИ
В конце XIX в. выдающийся испанский гистолог Сантъяго Рамон-и-Кахаль (нобелевский лауреат 1906 г.) выдвинул теорию, согласно которой морфологической единицей мозга являются нейроны, образующие ансамбли и взаимодействующие друг с другом в области специализированных контактов.
Он же утверждал: нейрональные системы способны менять функциональную активность под влиянием внешних стимулов. Эти представления нашли подтверждения в последующих исследованиях.
Он же утверждал: нейрональные системы способны менять функциональную активность под влиянием внешних стимулов. Эти представления нашли подтверждения в последующих исследованиях.
Так, известный российский нейрофизиолог, психиатр и психолог Владимир Бехтерев в начале XX в. показал: двигательная функция, нарушенная при частичном повреждении мозжечка, моторной зоны коры и неполном пересечении спинного мозга у собак, со временем восстанавливается. Для объяснения загадочного явления ученый исходил из положения о том, что функции поврежденных участков берут на себя неповрежденные. Он полагал: в основе компенсаторного замещения функций лежит реорганизация нервных связей, причем отчасти этот процесс управляется информацией, поступающей от нейронов-мишеней.
 А выдающиеся отечественные физиологи академики Иван Павлов (нобелевский лауреат 1904 г.) и Леон Орбели, рассматривая патологию мозга как естественное моделирование выключения тех или иных его отделов и соответствующих функций, подчеркивали: у человека и животных он характеризуется высокими компенсаторными возможностями. На основе этих наблюдений Орбели пришел к выводу: локальное повреждение мозга и нарушение соответствующих регуляторных функций со временем приводят к включению более простых и филогенетически относительно древних механизмов регуляции, что служит одним из важнейших проявлений пластичности мозга. Большой фактический материал, подтверждающий правильность таких взглядов, был накоплен в ходе двух мировых войн у пациентов с огнестрельными ранениями и черепно-мозговыми травмами. Но, как упоминалось, очевидные данные входили в серьезное противоречие с господствовавшими до второй половины XX в. представлениями.
А выдающиеся отечественные физиологи академики Иван Павлов (нобелевский лауреат 1904 г.) и Леон Орбели, рассматривая патологию мозга как естественное моделирование выключения тех или иных его отделов и соответствующих функций, подчеркивали: у человека и животных он характеризуется высокими компенсаторными возможностями. На основе этих наблюдений Орбели пришел к выводу: локальное повреждение мозга и нарушение соответствующих регуляторных функций со временем приводят к включению более простых и филогенетически относительно древних механизмов регуляции, что служит одним из важнейших проявлений пластичности мозга. Большой фактический материал, подтверждающий правильность таких взглядов, был накоплен в ходе двух мировых войн у пациентов с огнестрельными ранениями и черепно-мозговыми травмами. Но, как упоминалось, очевидные данные входили в серьезное противоречие с господствовавшими до второй половины XX в. представлениями.В то время нейронауки (нейроморфология, нейрофизиология, нейрохимия, неврология, нейрохирургия) строились на нескольких основных догмах. Они гласили: нейроны не способны к воспроизводству в организме взрослого животного и человека; сформировавшиеся в онтогенезе их ансамбли сохраняются в неизменном виде в течение всей последующей жизни; фенотип нервной клетки, в частности ее специфические синтезы и функциональные свойства, предопределены генетически, не зависят от среды и физиологических условий, в которых она функционирует. Эта «застывшая картина» кардинально изменилась во второй половине XX в. с появлением в ходе научно-технической революции принципиально новых подходов, позволивших проникнуть в тайны работы мозга. В результате удалось идентифицировать структурно-функциональные маркеры нейронов на молекулярном и моле-кулярно-генетическом уровне, а в конечном счете — выяснить механизмы их функционирования.
Даже при самом смелом полете фантазии наши выдающиеся предшественники не могли предположить всей сложности организации и функционирования мозга человека. Достаточно упомянуть, что по современным данным в его состав входит от 10 до 100 млрд нейронов, причем любой из них интегрирован в ансамбли с помощью 10-30 тыс. синапсов (Синапс — место структурно-функционального контакта между нейронами, в котором происходит передача информации от одной клетки к другой (прим. ред.), и каждую секунду в мозге возникает около 200 тыс. сигналов. Оказалось, основной стимул для реорганизации нейрональных ансамблей, перестройки химического фенотипа отдельных нейронов - изменения их микроокружения и внутренней среды мозга.
Они носят компенсаторный характер и направлены на поддержание гомеостаза не только этого уникального органа, но и организма в целом.
СИНТЕЗ СИГНАЛЬНЫХ МОЛЕКУЛ
Важнейшее свойство нейрона, определяющее его функциональную активность, — синтез так называемых сигнальных молекул, или нейротрансмиттеров, передающих информацию от одного нейрона к другому. До середины 1960-х годов известный их круг был ограничен «классическими нейротрансмиттерами» — ацетил-холином и моноаминами (норадреналин, адреналин, дофамин, серотонин). Каждый из них синтезируется из строго определенной аминокислоты с помощью ферментов по каскадному принципу. Появление иммунологических методов анализа способствовало обнаружению гораздо более многочисленной группы сигнальных молекул, состоящей из нескольких десятков, если не сотен нейропептидов. За их открытие американский биохимик Винсент дю Виньо в 1955 г., его соотечественники медик Эндрю Шалли и физиолог Роже Гиймен в 1977 г. были удостоены Нобелевских премий.
Качественный скачок в понимании механизмов пластичности мозга был сделан в 80-е годы XX в. благодаря методу двойного иммунологического мечения внутриклеточных белков — нейропептидов и ферментов синтеза классических сигнальных молекул. Используя его, шведский ученый Томас Хокфельт показал, что отдельный нейрон способен синтезировать несколько нейротрансмиттеров, а не только один, как считали ранее. Это позволило объяснить некоторые механизмы пластичности нейронов сменой синтеза одних сигнальных молекул на другие в зависимости от функционального состояния и микроокружения. Так, при повышенной потребности организма в вазопрессине — нейропептиде, регулирующем водно-солевой обмен, и функциональной недостаточности нейронов, его синтезирующих, он начинает дополнительно вырабатываться другими нейронами, в нормальных условиях участвующими в формировании иного соединения — окситоцина.
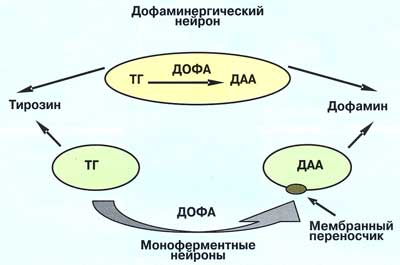
Синтез дофамина дофаминергическими нейронами из аминокислоты -
предшественницы тирозина
Свойство пластичности проявляется и в специфической регуляции выделения сигнальных молекул из нейрона. Оказалось, что в одном и том же аксоне (Аксон — отросток нейрона, проводящий нервные импульсы от тела клетки к иннервируемым органам или другим нервным клеткам (прим. ред.) несхожие по природе нейротрансмиттеры содержатся в различных субклеточных депо — пузырьках — и выходят в межклеточную среду независимо друг от друга. Это обеспечивается за счет различий частоты нервных импульсов: при низкой выделяются классические нейротрансмиттеры из мелких «синаптических» пузырьков, при высокой — нейропептиды, содержащиеся в крупных секреторных гранулах.
И, наконец, уже в первые годы XXI в. автором статьи с сотрудниками открыт ранее неизвестный путь синтеза классических нейротрансмиттеров — моноаминов немоноаминергическими нейронами, который, как выяснилось, служит одним из важнейших механизмов пластичности мозга. Стимулом для проведения этих исследований явилось обнаружение группой во главе с Хокфельтом в 1980-е годы так называемых моноферментных нейронов, экспрессирующих только один из ферментов синтеза моноаминов. Уже на начальном этапе наших работ убедительным, хотя и косвенным аргументом в пользу важного функционального значения этих нервных клеток стало выявление их широкого распространения по всему мозгу. Причем в некоторых его отделах количество моноферментных нейронов соизмеримо или даже выше, чем моноаминергиче-ских, обладающих полным набором ферментов.
Наиболее многочисленны нейроны, содержащие один из ферментов синтеза дофамина, — весьма распространенного и функционально значимого нейро-трансмиттера, биохимического предшественника адреналина и норадреналина. В одних нейронах содержится только тирозингидроксилаза (первый фермент синтеза дофамина), в других — лишь декарбоксилаза ароматических аминокислот (второй фермент синтеза). Мы впервые получили экспериментальные доказательства того, что упомянутые моноферментные нейроны совместно синтезируют этот важнейший нейротрансмиттер.
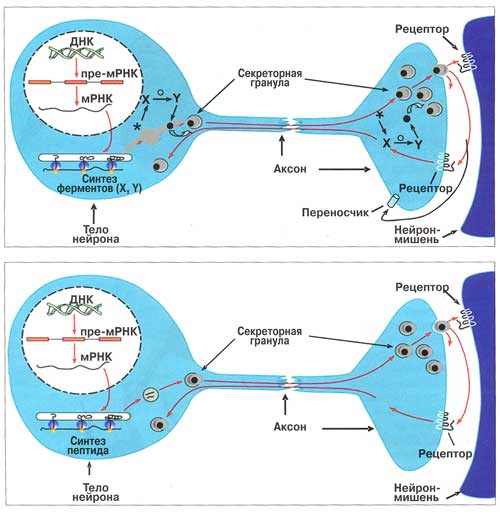
1 - нейрон, синтезирующий классические нейротрансмиттеры - моноамины из аминокислоты-предшественницы2 - нейрон, синтезирующий в качестве нейротрансмиттеров нейропептиды
Представления о функциональной и метаболической консервативности нервной клетки были окончательно разрушены, когда стало ясно: экспрессию генов и формирование ферментов синтеза классических нейротрансмиттеров регулируют межклеточные химические сигналы, к которым относится широкий круг физиологически активных веществ как мозгового, так и периферического происхождения — нейропептиды, гормоны, ростовые (нейротрофические) факторы и др. Значит, при изменении окружающей среды нейрон может принципиально перестраивать свой химический фенотип, например, вместо ацетилхолина (Ацетилхолин — медиатор (переносчик) нервного возбуждения. При поступлении в кровь понижает кровяное давление, замедляет сердцебиение и пр. (прим. ред.) начать синтезировать катехоламины (адреналин, норадреналин, дофамин), т.е. другие медиаторы нервной системы.
МЕЖНЕЙРОНАЛЬНЫЕ ВЗАИМОДЕЙСТВИЯ
Современные экспериментально-методические подходы подтвердили гениальные предположения наших великих предшественников о том, что при различных функциональных состояниях мозга в норме и, особенно, в патологии происходит реорганизация нейрональных ансамблей. Такая пластичность проявляется, в частности, в новообразовании и исчезновении синапсов, изменении числа и конфигурации их постсинаптических компонентов — шипиков, представляющих собой короткие боковые выросты дендритов, ряде других особенностей. Более детальный анализ показал: крупные шипики стабильны в течение длительного времени (месяцы или даже годы), в то время как мелкие в зависимости от функциональной активности нейрона мобильны и способны быстро возникать, исчезать или, наоборот, превращаться в крупные. В свете этих данных считается, что синапсы, образованные при участии крупных шипиков, вовлечены в долговременную память, а сформированные при участии мелких — субстрат кратковременной памяти.
Вслед за открытием способности нервной клетки синтезировать одновременно несколько нейротранс-миттеров было показано, что на пост- и пресинаптической мембранах (Постсинаптическая мембрана - участок мембраны управляемой (получающей сигнал) клетки, входящий в состав синапса. Пресинап-ическая мембрана — участок мембраны управляющей (передающей сигнал) клетки, также входящий в состав синапса (прим. ред.) локализованы рецепторы ко всем сигнальным молекулам, выделяющимся из преси-наптической терминали аксона. В этом случае данные молекулы либо вызывают специфический физиологический ответ нейрона-мишени, либо модулируют действие одних нейротрансмиттеров на другие. Более того, один нейрон с помощью различных нейротрансмиттеров может передавать информацию разным мишеням. Иными словами, доказана широта функциональных и метаболических возможностей нейронов, их способность при необходимости переносить «центр тяжести» регуляции с одного нейро-трансмиттера на другой и соответственно с одной функции на другую.
Представления Рамона-и-Кахаля о взаимодействии нейронов только в области локальных специализированных контактов — синапсов — в последнее время существенно расширены в результате обнаружения рецепторов к сигнальным молекулам по всей плазматической мембране нейрона. При этом выяснено, что он погружен в среду, содержащую многочисленные нейротрансмиттеры, и они действуют на всю его поверхность, оказывая диффузное, так называемое нейромодуляторное влияние.
Один из важнейших факторов, определяющих конечный физиологический ответ нейрона, — локальная концентрация нейротрансмиттеров в его окружении. Плотность сигнальных молекул в межклеточном пространстве определяется скоростью не только их выделения, но и разрушения специфическими ферментами, причем уровень их экспрессии и активность также в полной мере зависят от микроокружения нейрона.
Нейроны чувствительны не только к сигнальным молекулам мозгового происхождения, но и к их периферическим аналогам — гормонам липидной природы, преодолевающим гематоэнцефалический барьер (Тематоэнцефалический барьер — физиологический механизм, регулирующий обмен веществ между кровью, спинно-мозговой жидкостью и мозгом. Защищает мозг от чужеродных веществ, введенных в кровь, или продуктов нарушенного обмена веществ (прим. ред). Последние, в отличие от нейротрансмиттеров, проникают в нейрон, действуя на рецепторы, локализованные в цитоплазме или ядре. При этом они могут играть роль «эпигенетических» факторов, способных изменять функциональную активность генов, и в конечном счете — химический фенотип нейрона. Доказательства ключевой роли его микроокружения в таком процессе получены при пересадке нервных клеток из одной области мозга в другую.
НОВООБРАЗОВАНИЕ НЕЙРОНОВ
Первые попытки опровергнуть одно из основополагающих положений нейронаук о том, что нейроны формируются лишь в период эмбрионального развития и не воспроизводятся во взрослом организме, были предприняты еще в 60-е годы XX в. нашим соотечественником Андреем Поленовым (впоследствии член-корреспондент РАН) и американским исследователем Джозефом Олтманом. Однако их работы вызвали поток критики, и развитие столь важного направления затормозилось на многие годы. Лишь относительно недавно получены прямые доказательства: нейроны образуются в мозге из стволовых клеток* (ежедневно — десятки тысяч!) или клеток-предшественников в течение всей жизни животного и человека. Есть основания считать, что это один из важных механизмов пластичности уникального органа, обеспечивающих непрерывное замещение дегенерирующих нервных клеток новыми — как в норме, так, возможно, и в патологии: при острых (ишемии) и хронических (болезни Паркинсона, Альцгеймера и др.) нейродегенеративных заболеваниях.
В настоящее время ученые пытаются найти отделы, в которых идет новообразование нейронов. Пока обнаружены всего два — в стенке боковых желудочков мозга на уровне стриатума (Стриатум — парное скопление серого вещества в толще полушарий большого мозга, состоящее у приматов из хвостатого и чечевицеобразного ядер, разделенных прослойкой белого вещества (прим. ред.) их ежедневно «рождается» около 30 тыс., а в зубчатой извилине гиппокампа (Гиппокамп — извилина полушария головного мозга в основании височной доли; участвует в эмоциональных реакциях и механизмах памяти (прим. ред.). — 3-9 тыс. Из стенки боковых желудочков в течение нескольких дней они мигрируют в область обонятельных луковиц, где половина нейронов дифференцируется и интегрируется в существующие ансамбли, а другие погибают. Причем большая часть сохранившихся (75-99%) становится клетками, синтезирующими нейротрансмиттер — гамма-амино-масляную кислоту, меньшая превращается в синтезирующие ее же и/или тирозингидроксилазу.
Относительно образования нейронов в других отделах мозга, в частности в коре, сведения противоречивые. В одних работах приводятся доказательства такого процесса в неокортексе (верхний слой коры), а также в префронтальной, нижней височной и задней теменной областях коры, в других это полностью отрицается.
Образование нейронов регулируется широким спектром «эпигенетических факторов». Они включают сигнальные молекулы как мозгового происхождения — классические нейротрансмиттеры, нейропептиды, ростовые факторы, так и периферического — стероидные гормоны (половые и коры надпочечников). Это микроокружение влияет на развитие нейрона и контролирует пролиферацию (размножение) стволовых клеток или клеток-предшественников. Предполагается, что процесс новообразования активизируется при травме и ишемии. Значит, в процессе жизни индивида происходит не только постепенная гибель нейронов, но, по крайней мере, частичное их замещение, что имеет особое значение при острых и хронических нейродегенеративных заболеваниях.
ПЛАСТИЧНОСТЬ МОЗГА ПРИ ПАТОЛОГИИ
Исследования последних десятилетий показали: механизмы пластичности мозга в норме и при патологии качественно не отличаются, однако в последнем случае они количественно выражены в гораздо большей степени. Значительный интерес для нейро-наук и медицины представляет анализ этих механизмов при социально значимых хронических нейроде-генеративных заболеваниях (гиперпролактинемии, болезнях Паркинсона, Альцгеймера и др.). Несмотря на существенные различия в клинических проявлениях, их патогенез принципиально сходен. Ключевое звено — прогрессирующая дегенерация одной или нескольких популяций специфических, как правило, аминергических нейронов, локализованных в определенных отделах мозга. Заболевания развиваются в течение 20-30 лет без проявления симптомов (так называемая преклиническая стадия), а перейдя в клиническую, несмотря на лечение, быстро прогрессируют, приводя к инвалидности и в итоге — к летальному исходу. Первые симптомы большинства из них, в частности болезней Паркинсона и Альцгеймера, проявляются обычно после 55 лет, причем частота их встречаемости увеличивается с возрастом. Затраты на лечение и реабилитацию такого пациента в высокоразвитых странах достигают 25 тыс. дол. в год.
Одна из причин развития гиперпролактинемии, поражающей людей относительно молодого возраста и приводящей к нарушению репродуктивной функции, — дегенерация дофаминергических нейронов гипоталамуса (отдел промежуточного мозга, в котором расположены центры вегетативной нервной системы). При этом снижается уровень синтеза дофамина, ингибирующего секрецию пролактина (Пролактин — гормон, вырабатываемый гипофизом. У млекопитающих стимулирует развитие молочных желез, образование молока и формирует материнский инстинкт (прим. ред.) клетками гипофиза.
Моделирование нами гиперпролактинемии на лабораторных животных введением в мозг нейротоксина, вызывающего гибель дофаминергических нейронов, показало: вслед за первой фазой заболевания, проявляющейся повышением уровня секреции пролактина, следует вторая, характеризующаяся его нормализацией. Мы убедились, что дефицит дофамина компенсируется его синтезом иными — моноферментными — нейронами (о механизмах этого процесса речь шла выше).
Второй пример пластичности мозга при функциональной недостаточности дофаминергических нейронов - болезнь Паркинсона. В отличие от гиперпролактинемии при этом недуге дегенерируют дофаминергические нейроны так называемой нигростриатной системы — ключевого звена центральной регуляции моторного (двигательного) поведения. У больных патология проявляется в основном в виде дрожания рук и/или скованности движений. Эти нейроны располагаются в черной субстанции мозга (Черная субстанция — одно из подкорковых ядер, расположенное в среднем мозге (прим. ред.), а их аксоны проецируются в стриатум, где дофамин выделяется и действует на нейроны-мишени.
Первые симптомы болезни Паркинсона проявляются обычно после 55-60 лет при дегенерации не менее 70-80% дофаминергических нейронов. Причем пока врачи исходят из широко распространенных представлений: мозг человека создан с большим запасом прочности, и 20-30% его специфических нейронов вполне достаточно для обеспечения нормальной регуляции любой функции, включая моторное поведение. Увы, все попытки их поддержать или даже усилить активность с помощью медикаментозной терапии приводят только к ограниченному во времени положительному эффекту.
Неэффективной оказалась и попытка компенсации локального дефицита дофамина в стриатуме путем пересадки эмбриональных дофаминергических нейронов, на которую в последние два десятилетия возлагали особенно большие надежды. Да, при этом они дифференцируются, синтезируют и выделяют дофамин, а также устанавливают синаптические связи с нервными клетками реципиента. Но операция лишь временно улучшает состояние пациента, причем далеко не каждого. Поэтому, несмотря на определенные успехи в клинической нейротрансплантологии, этот подход до сих пор не рекомендован для лечения. Он требует дальнейшего совершенствования на экспериментальном уровне с использованием не только эмбриональных, но и стволовых, а также генно-инженерных клеток нейронального и ненейронального происхождения.
Следует отметить: несмотря на огромные усилия неврологов, нейрохирургов, фармакологов и масштабные финансовые инвестиции в разработку методов борьбы с болезнью Паркинсона, за 190 лет, прошедшие с первого ее описания английским врачом Джеймсом Паркинсоном, во всем мире не излечено ни одного человека, ею страдающего. Это свидетельствует либо о фатальном характере патологии, либо, по нашему мнению, об ошибочной идеологии, положенной в основу современных методов диагностики и терапии такого рода недугов.
По нашим представлениям, для нормального функционирования дофаминергического звена регуляции моторного поведения необходимо наличие большинства предсуществующих в норме дофаминергических нейронов. Отсутствие же внешних проявлений заболевания в течение 20-30 лет после его начала, вероятно, — результат компенсации функциональной недостаточности дегенерирующих нейронов за счет включения высокоэффективных компенсаторных механизмов пластичности мозга. Неоспоримые доказательства этого получены на экспериментальных моделях. Показано: при гибели до 50% дофаминергических нейронов в стриатуме, содержащем нейроны-мишени к дофамину, сохраняется нормальный уровень нейротрансмиттера в межклеточном пространстве. Это обеспечивается, в первую очередь, включением кооперативного синтеза его предшественников моноферментными нейронами. Действительно, их число увеличивается при дегенерации дофаминергических нейронов в разы, достигая у приматов нескольких десятков тысяч.
Несмотря на эффективность описанного, а также ряда других компенсаторных механизмов (увеличение секреторной активности сохранившихся дофаминергических нейронов, повышение чувствительности нейронов-мишеней к дофамину и др.), продолжающаяся дегенерация дофаминергических нейронов рано или поздно приводит к снижению концентрации дофамина в межклеточном пространстве до такого уровня, при котором он не способен вызывать адекватный физиологический ответ при действии на нейроны-мишени. И тут же появляются первые признаки нарушения моторного поведения, т.е. заболевание переходит в клиническую стадию, приводя к инвалидизации и последующей гибели больного.
Отсюда вытекают две задачи, решение которых может привести к успеху в лечении ряда нейродегенеративных заболеваний. Первая связана с разработкой доклинической их диагностики, вторая — с поиском методов профилактики в преклинической стадии, основанных на медикаментозном управлении компенсаторными процессами и замедлении дегенерации специфических нейронов.
Иллюстрации автора
Академик Михаил УГРЮМОВ,
заведующий лабораториями Института биологии развития
им. Н.К. Кольцова РАН,
Института нормальной физиологии им. П.К. Анохина
РАМН (Москва), профессор Университета им. П. и М. Кюри (Париж)
заведующий лабораториями Института биологии развития
им. Н.К. Кольцова РАН,
Института нормальной физиологии им. П.К. Анохина
РАМН (Москва), профессор Университета им. П. и М. Кюри (Париж)






 Издательство «Свиньин и сыновья» выпустило несколько сотен самых разных по жанру, объему и авторам, но неизменно высококультурных изданий
Издательство «Свиньин и сыновья» выпустило несколько сотен самых разных по жанру, объему и авторам, но неизменно высококультурных изданий





