Мизенбек Г. Как зажечь мозг
Хитроумное сочетание оптики и генетики позволяет нейробиологам не только с небывалой точностью картировать работу мозга, но и управлять им. Новые методы, в которых свет используется для регистрации и управления активностью нейронов, позволяет ученым изучать отдельные их группы. Эта работа когда-нибудь поможет лучше понять функционирование мозга…
Об авторе
Геро Мизенбек (Gero Miesenbock) недавно перешел из Йельского университета в Оксфордский университет, где занял должность профессора физиологии. Именно этот пост с 1913 г. до ухода на пенсию в 1935 г. занимал Чарлз Шеррингтон, один из основателей современной нейробиологии.
ОСНОВНЫЕ ПОЛОЖЕНИЯ
• Нейробиологи привыкли изучать функционирование мозга путем стимуляции или регистрации активности отдельных нервных клеток с помощью электродов. Однако это косвенный метод, что затрудняет анализ получаемых результатов.
• Молодая наука оптогенетика сочетает в себе генную инженерию с оптикой для наблюдения и управления группами нейронов. Она позволяет ученым изучать целые нейронные сети. Такой подход революционизирует изучение работы мозга.
 В 1937 г. великий нейрофизиолог сэр Чарлз Скотт Шеррингтон (Sir Charles Scott Sherrington), работавший в Оксфордском университете, высказал мысль, которая со временем стала классической метафорой работы мозга. Он попытался представить себе, что будет, если активные нервные клетки и связи между ними начнут светиться. Тогда во время глубокого сна лишь отдельные участки мозга будут слегка мерцать, делая его похожим на звездное небо. Однако после пробуждения все будет выглядеть так, «словно Млечный Путь пустился в пляс, — писал Шеррингтон. — Сразу же весь головной мозг окутает волшебное сияние, и миллионы огоньков будут кружиться, рождая замысловатые, никогда не повторяющиеся узоры, в которых скрыт великий смысл».
В 1937 г. великий нейрофизиолог сэр Чарлз Скотт Шеррингтон (Sir Charles Scott Sherrington), работавший в Оксфордском университете, высказал мысль, которая со временем стала классической метафорой работы мозга. Он попытался представить себе, что будет, если активные нервные клетки и связи между ними начнут светиться. Тогда во время глубокого сна лишь отдельные участки мозга будут слегка мерцать, делая его похожим на звездное небо. Однако после пробуждения все будет выглядеть так, «словно Млечный Путь пустился в пляс, — писал Шеррингтон. — Сразу же весь головной мозг окутает волшебное сияние, и миллионы огоньков будут кружиться, рождая замысловатые, никогда не повторяющиеся узоры, в которых скрыт великий смысл».Поэтическая метафора Шеррингтона содержит в себе важную научную идею: увидеть работу мозга можно с помощью оптики. Совместная деятельность нейронов, из которой рождается мышление и поведение, остается одной из самых трудных неразрешенных проблем в биологии, и основная причина кроется в том, что ученые не могут увидеть работу целостных нейронных сетей. С помощью электродов исследователи обычно регистрируют активность лишь одного-двух нейронов и таким образом видят крошечный осколок огромной картины. Из-за отсутствия остальных фрагментов им не удается разобраться в том, что же представляет собой вся картина в целом. Однако если бы получилось наблюдать за обменом сигналов между нейронами, то можно было бы понять, как организованы связи в нейронных сетях и как они функционируют. Такая заманчивая идея вдохновила ученых на поиск способов реализации мечты Шеррингтона.
Усилия исследователей привели к рождению молодой области науки, называемой оптогенетикой, в которой методы генной инженерии сочетаются с оптикой. С ее помощью специалистам уже удалось увидеть функционирование некоторых групп нейронов. Более того, данный подход даже позволил им управлять нейронами с помощью света. Эти достижения рождают надежду, что когда-нибудь благодаря оптогенетике ученым удастся раскрыть работу мозга, а врачам — вылечить ряд заболеваний.
Колдовство со светом
Попытки всерьез реализовать мечту Шеррингтона начались в 1970-х гг. Подобно цифровым компьютерам нервная система работает на электричестве; нейроны кодируют информацию в электрических сигналах, так называемых потенциалах действия. Импульсы амплитудой менее десятой доли напряжения пальчиковой батарейки заставляют нервную клетку выделять молекулы нейромедиаторов, которые активируют или тормозят другие клетки. Стремясь сделать электрические сигналы видимыми, Лоренс Коэн (Lawrence В. Cohen) из Йельско-го университета испытал множество флуоресцентных красителей в поиске таких, которые реагировали бы на отклонение электрического потенциала изменением цвета или интенсивности свечения. Ему это удалось, и, окрашивая нейроны такими красителями, Коэн мог наблюдать их активность под микроскопом.
Попытки всерьез реализовать мечту Шеррингтона начались в 1970-х гг. Подобно цифровым компьютерам нервная система работает на электричестве; нейроны кодируют информацию в электрических сигналах, так называемых потенциалах действия. Импульсы амплитудой менее десятой доли напряжения пальчиковой батарейки заставляют нервную клетку выделять молекулы нейромедиаторов, которые активируют или тормозят другие клетки. Стремясь сделать электрические сигналы видимыми, Лоренс Коэн (Lawrence В. Cohen) из Йельско-го университета испытал множество флуоресцентных красителей в поиске таких, которые реагировали бы на отклонение электрического потенциала изменением цвета или интенсивности свечения. Ему это удалось, и, окрашивая нейроны такими красителями, Коэн мог наблюдать их активность под микроскопом.
Красители могут также сигнализировать о разряде нейронов, реагируя не на изменение потенциала, а на поток определенных ионов. Когда нейрон генерирует потенциал действия, каналы в его мембране открываются и впускают внутрь клетки ионы кальция, что в свою очередь ведет к выбросу нейромедиаторов. В 1980 г. Роджер Цзянь (Roger Y. Tsien), работающий в настоящее время в Калифорнийском университете в Сан-Диего, приступил к синтезу красителей, которые сообщали бы об колебаниях концентрации кальция изменением яркости своей флуоресценции. Такие оптические индикаторы оказались чрезвычайно ценным инструментом, раскрыв новые окна для наблюдения за процессами обработки информации в отдельных нейронах и небольших нервных сетях. В минувшем году Цзянь получил за свои исследования Нобелевскую премию. Синтетические красители все же имеют один серьезный недостаток. Дело в том, что нервная ткань состоит из множества различных типов клеток — например, в мозге мыши имеются многие сотни типов нейронов плюс еще множество разновидностей вспомогательных клеток. Поскольку взаимодействие между определенными нейронами составляет основу обработки информации в нервной системе, то для того, чтобы понять, как работает та или иная нейронная сеть, необходимо уметь идентифицировать отдельных игроков и следить за ними, замечая моменты их включения (разряда потенциалом действия) и выключения. Однако поскольку синтетические красители окрашивают все клетки подряд, то практически невозможно узнать, от каких именно типов клеток идет оптический сигнал.
Гены и фотоны
Оптогенетика родилась из осознания того, что генетические манипуляции могут быть ключом к решению проблемы тотального окрашивания. Все клетки одного индивида содержат одни и те же гены, однако они отличаются друг от друга благодаря тому, что в них активны разные гены. Например, нейроны, высвобождающие при своей активации нейромедиатор дофамин, нуждаются в ферментной фабрике, производящей и упаковывающей данное вещество. Соответственно, в дофаминергических (т.е. выделяющих дофамин) нейронах должны быть включены гены, кодирующие все составные части фабрики, однако в прочих нейронах эти же гены выключены.
Оптогенетика родилась из осознания того, что генетические манипуляции могут быть ключом к решению проблемы тотального окрашивания. Все клетки одного индивида содержат одни и те же гены, однако они отличаются друг от друга благодаря тому, что в них активны разные гены. Например, нейроны, высвобождающие при своей активации нейромедиатор дофамин, нуждаются в ферментной фабрике, производящей и упаковывающей данное вещество. Соответственно, в дофаминергических (т.е. выделяющих дофамин) нейронах должны быть включены гены, кодирующие все составные части фабрики, однако в прочих нейронах эти же гены выключены.
В теории существует возможность сделать так, чтобы биологический выключатель, активирующий необходимые для синтеза дофамина гены, одновременно включал бы и гены, кодирующие краситель, которые можно внедрить с помощью методов генной инженерии. В результате у такого животного были бы окрашены только дофаминергические нейроны. Если бы исследователи заглянули в мозг этих существ (что вполне реально), то они смогли бы увидеть функционирование исключительно одних дофаминергических нейронов. Более того, активность таких клеток можно было бы наблюдать в интактном живом мозге. Однако для этого нужно, чтобы краситель кодировался геном, т.е. чтобы он был белком.
Первые демонстрации того, что красители, закодированные в генах, могут служить индикаторами нейронной активности, выполнили десять лет назад независимо Цзянь, Эхуд Исакофф (Ehud Y. Isacoff) из Калифорнийского университета в Беркли и я совместно с Джеймсом Ротманом (James E. Rothrnan), ныне работающим в Йельском университете. Во всех случаях ген красителя был позаимствован из морских организмов, чаще всего из медуз, производящих так называемый зеленый флуоресцирующий протеин. Мы слегка поколдовали над геном, чтобы его белковый продукт мог детектировать изменения потенциала и концентрации кальция, сопутствующие генерации сигнала в клетке и выбросу нейромедиаторов.
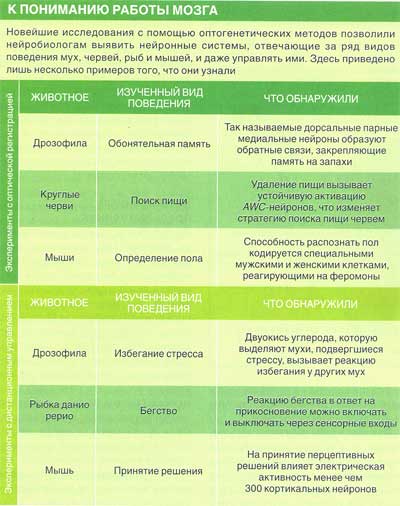
Затем мы и другие ученые создали животных, у которых гены, кодирующие такие индикаторы, включаются лишь в строго определенных типах нейронов. Было проанализировано множество излюбленных генетиками организмов, включая червей, рыбок данио рерио и мышей, однако наибольшую готовность раскрыть свои секреты проявили дрозофилы. Их мозг достаточно компактен и целиком виден под микроскопом. Более того, этих мушек легко видоизменять генетически, и за целое столетие исследований было найдено множество генетических выключателей, необходимых нам для нацеливания на определенные группы нейронов. Именно на них Роберт Рурда (Robert D. Roorda), Мина Нг (Minna Ng) и я — все мы тогда работали в Мемориальном раковом центре Слоуна-Кеттерин-га в Нью-Йорке — получили первые изображения работы строго определенных групп нейронов в интактном мозге. С тех пор были открыты новые нейронные группы и новые принципы. Например, в прошлом году мы обнаружили у дрозофилы нейроны, обрабатывающие информацию о запахе, которые вносят в систему «фоновый шум». Мы полагаем, что они позволяют усиливать слабые сигналы и повышают чувствительность животного к запахам, следовательно, позволяют им легче находить пищу. Данные индикаторы стали мощным инструментом, позволяющим наблюдать за обменом сигналами между нейронами. Однако тогда, в конце 1990-х гг., перед нами все еще стояла одна проблема. Большинство экспериментов по изучению функционирования нервной системы имеют весьма косвенный характер. Исследователи вызывают реакцию в мозге, предъявляя животному изображение, звуковой тон или запах, и затем пытаются понять, как распространяется сигнал — для этого они размещают электроды в различных точках его прохождения и регистрируют возникающие там электрические сигналы. К сожалению, формат сенсорного сигнала сильно изменяется по мере его распространения в мозге. В результате, чем дальше мы оказываемся от глаза, уха или носа, тем сложнее становится понять, какие именно сигналы лежат в основе зарегистрированного ответа. И, конечно же, для многих систем мозга, которые связаны не с обработкой сенсорной информации, а с движением, мышлением или эмоциями, такой подход вообще неприемлем: их нельзя активировать непосредственно с помощью сенсорных стимулов.
От наблюдения к управлению
Проблему можно было бы решить, если иметь возможность стимулировать определенные группы нейронов непосредственно, в обход сенсорных органов. Мы задались вопросом, нельзя ли создать такие инструменты, которые не только позволяли бы наблюдать за активностью нервных клеток, но также и активировали бы ранее заданные типы нейронов.
Мы вместе с моим коллегой Борисом Земельманом (Boris V. Zemelman), в настоящее время работающим в Медицинском институте Говарда Хьюза, взялись за эту проблему. Нам было известно, что если бы мы смогли генетически запрограммировать некое спусковое устройство, управляемое светом, и ввести его в нейроны, то можно было бы преодолеть несколько препятствий, которые мешают исследованию работы мозга с помощью электродов. Поскольку одновременно в мозг можно ввести лишь ограниченное количество электродов, ученые имеют возможность регистрировать или стимулировать лишь небольшое количество клеток за раз. Кроме того, с помощью электродов трудно адресоваться точно к заданным типам клеток, и к тому же они ограничивают подвижность экспериментального животного.
Если бы нам удалось с помощью этого спускового механизма одновременно включать все интересующие нас нейроны (например, дофаминер-гические), и если бы это было возможно делать дистанционно с помощью света, то нам уже не нужно было бы точно знать заранее, где именно в мозге они располагаются, и нас бы не волновало их смещение при движениях животного. Если бы стимуляция таких клеток привела к изменению поведения, то мы бы убедились, что они регулируют данный тип поведения. В то же самое время, если бы мы еще и снабдили клетки геном индикатора, то активные клетки начинали бы светиться, раскрывая свое местонахождение в нервной системе. Вероятно, многократно повторяя такой эксперимент на животных, у которых спусковое устройство располагалось бы в разных типах клеток, мы в конечном счете смогли бы воссоздать всю последовательность событий, ведущую от возбуждения нейронов к поведению, и выявить всех участников цепочки. Для этого нам нужно было лишь найти такой спусковой механизм, закодированный в генах, который преобразовывал бы свет в электрический импульс.
Мы решили, что искать его нужно в клетках, от природы генерирующих электрические сигналы в ответ на свет, например в фоторецепторах глаза. В этих клетках имеются воспринимающие свет белки, называемые родопсинами, которые при действий на них света дают команду на открывание и закрывание ионных каналов в мембране клетки, и тем самым управляют потоком ионов и генерируют электрические сигналы. Мы решили трансплантировать гены, кодирующие родопсин (плюс некоторые вспомогательные гены, нужные для функционирования родопсина) в культуру нейронов, выращиваемых в чашках Петри. В таких простых условиях мы могли проверить, приведет ли освещение к активации нейронов. Наши эксперименты оказались удачными — в начале 2002 г., через четыре года после создания первых индикаторов, записанных в генах и позволявших регистрировать активность нейронов, появились и первые спусковые устройства, также генетически закодированные.
Мухи с дистанционным управлением
В последние годы исследователи открыли другие светочувствительные белки, в том числе меланопсин, который содержится в специализированных клетках сетчатки, помогающих нам синхронизировать биологические часы с вращением Земли. Совместными усилиями Георга Нагеля (Georg Nagel) из института Биофизики имени Макса Планка во Франкфурте, Карла Диссерота (Karl Deisseroth) из Стэнфордского университета и Стефана Херлице (Stefan Herlitze) из Университета Западного резервного района было показано, что для данной цели очень хорошо подходит еще один белок под названием каналородопсин-2 (вещество, помогающее водорослям плыть в нужном направлении). Еще некоторое количество других «спусковых крючков», закодированных в генах, которыми можно управлять с помощью светочувствительных химических соединений, синтезировали мы и Исакофф совместно с его коллегами по Калифорнийскому университету в Беркли Ричардом Крамером (Richard H. Kramer) и Дирком Тронером (Dirk Trauner).
В последние годы исследователи открыли другие светочувствительные белки, в том числе меланопсин, который содержится в специализированных клетках сетчатки, помогающих нам синхронизировать биологические часы с вращением Земли. Совместными усилиями Георга Нагеля (Georg Nagel) из института Биофизики имени Макса Планка во Франкфурте, Карла Диссерота (Karl Deisseroth) из Стэнфордского университета и Стефана Херлице (Stefan Herlitze) из Университета Западного резервного района было показано, что для данной цели очень хорошо подходит еще один белок под названием каналородопсин-2 (вещество, помогающее водорослям плыть в нужном направлении). Еще некоторое количество других «спусковых крючков», закодированных в генах, которыми можно управлять с помощью светочувствительных химических соединений, синтезировали мы и Исакофф совместно с его коллегами по Калифорнийскому университету в Беркли Ричардом Крамером (Richard H. Kramer) и Дирком Тронером (Dirk Trauner).
Следующий шаг заключался в демонстрации работы нашего спускового устройства в живом животном. Эту задачу я поставил перед моей первой студенткой Сусанной Лима (Susana Q. Lima). Для того чтобы получить доказательство самого принципа, мы нацелились на простейшую нейронную систему у дрозофил, состоящую из небольшого количества клеток. Было известно, что данные клетки управляют характерным поведением — эффектной реакцией бегства, при которой насекомое резко распрямляет ноги, чтобы оторваться от земли, а оказавшись в воздухе, раскрывает крылья и улетает. Вся последовательность событий запускается электрическими импульсами, рождающимися всего в двух из 150 тыс. нейронов мозга мухи. Эти командные нейроны активируют подчиненные им системы нейронов, называемые генераторами двигательных паттернов, которые в свою очередь отдают команды мышцам, обеспечивающим движения ног и крыльев мухи.
Мы обнаружили генетический выключатель, всегда активированный лишь в этих двух командных нейронах и ни в каких других, и другой выключатель, активированный в соответствующих клетках генератора двигательных паттернов, но не в командных нейронах. Воспользовавшись ими, мы создали мух, у которых либо командные нейроны, либо нейроны генератора двигательных паттернов синтезировали спусковое устройство, реагирующее на свет. К нашему восторгу, и те, и другие мухи взмывали в воздух, стоило только направить на них луч лазера (который был достаточно сильным, чтобы пройти через кутикулу интактных насекомых и достигнуть их нервной системы). Таким образом, подтвердилось, что и командные нейроны, и клетки генератора двигательного паттерна участвуют в реакции бегства, и мы доказали, что наши спусковые устройства действительно работают. Только нужные нейроны, содержащие «спусковой крючок», знали, как отвечать на световой стимул — нам не нужно было нацеливаться лазером точно на эти клетки. Все происходило так, как если бы мы вели радиопередачу на город, в котором стоят 150 тыс. домов, но лишь в немногих из них есть радиоприемник, необходимый для декодирования сигнала, остальные же просто не могут принять наше сообщение.
Оставалась все же одна досадная проблема. Командные нейроны, запускающие бегство, сами активируются по волокнам, идущим от глаз. Данные входы активируют рефлекторную реакцию в ответ на снижение освещенности: например, так происходит, когда приближающийся хищник отбрасывает тень. (Вы сами наверняка знакомы с этим явлением, если когда-нибудь пытались прихлопнуть муху: стоит только приготовиться ударить, как насекомое тут же улетает.) Нас беспокоило то, что в нашем случае реакция бегства могла проявляться в ответ на лазерный импульс, а не как следствие прямого управления нейронами.
Для того чтобы избавиться от сомнений, мы провели простой, хотя и жестокий эксперимент: отрезали нашим мухам головы. В результате мы получили безголовых мух (они могут так прожить один-два дня), у которых остались неповрежденными системы нейронов генератора двигательного паттерна, располагающиеся в грудных ганглиях, которые приблизительно соответствуют спинному мозгу позвоночных. При активации этих нейронов с помощью света тела мух, остававшиеся до того неподвижными, резко взмывали в воздух. Несмотря на то что их полет был неуклюжим и заканчивался ударом или падением, он сам по себе доказывал, что нейронами управлял лазер — ведь у безголовых насекомых не оставалось никакого другого способа воспринимать свет.
Мы также создали мух, у которых световые спусковые устройства имелись только в нейронах, синтезирующих нейромедиатор дофамин.
Под действием лазерного луча насекомые неожиданно становились более активными и начинали интенсивно обследовать окружающее пространство. Известно, что дофамин помогает животным предсказывать появление вознаграждения или наказания, и наши результаты с этим согласуются: мухи не просто становились более активными, они начинали по-новому обследовать территорию, словно ожидали что-то приобрести или потерять.
Неожиданный предшественник
За три дня до выхода в свет номера журнала Cell, в котором сообщалось об этих экспериментах, я летел в Лос-Анджелес, чтобы прочитать там лекцию. Один мой знакомый дал мне недавно вышедший роман Тома Вульфа (Tom Wolfe) «Я — Шарлотта Симоне» (I Am Charlotte Simmons): он полагал, что меня заинтересует, как в нем характеризуются нейробиологи, не говоря уж о том, что книга была отмечена Literary Review за худшую сексуальную сцену в литературе. Сидя в самолете, я читал место, где Шарлотта приходит на лекцию о работе некоего Хосе Дельгадо, который также умеет управлять поведением животных на расстоянии — только при помощи не света, а радиосигналов, которые он передает на электроды, имплантированные в мозг. Испанец по национальности, Дельгадо рисковал своей жизнью, чтобы продемонстрировать свою правоту, и остановил разъяренного быка. Это, заявляет вымышленный лектор в романе Вульфа, стало поворотным моментом в развитии нейробиологии и нанесло решительное поражение дуализму (представлению о том, что мышление якобы существует независимо от мозга). Если физические манипуляции с мозгом могли заставить быка изменить свое намерение, то мышление и мозг должны представлять собой единое целое.
За три дня до выхода в свет номера журнала Cell, в котором сообщалось об этих экспериментах, я летел в Лос-Анджелес, чтобы прочитать там лекцию. Один мой знакомый дал мне недавно вышедший роман Тома Вульфа (Tom Wolfe) «Я — Шарлотта Симоне» (I Am Charlotte Simmons): он полагал, что меня заинтересует, как в нем характеризуются нейробиологи, не говоря уж о том, что книга была отмечена Literary Review за худшую сексуальную сцену в литературе. Сидя в самолете, я читал место, где Шарлотта приходит на лекцию о работе некоего Хосе Дельгадо, который также умеет управлять поведением животных на расстоянии — только при помощи не света, а радиосигналов, которые он передает на электроды, имплантированные в мозг. Испанец по национальности, Дельгадо рисковал своей жизнью, чтобы продемонстрировать свою правоту, и остановил разъяренного быка. Это, заявляет вымышленный лектор в романе Вульфа, стало поворотным моментом в развитии нейробиологии и нанесло решительное поражение дуализму (представлению о том, что мышление якобы существует независимо от мозга). Если физические манипуляции с мозгом могли заставить быка изменить свое намерение, то мышление и мозг должны представлять собой единое целое.
Сразу же после приземления в Лос-Анджелесе я нашел информацию о Дельгадо. Он был профессором в том же университете, где работал и я, и написал книгу «Физический контроль над разумом: путь к психоцивилизованному обществу» (Physical Control of the Mind: Toward a Psychocivilized Society), которая вышла в 1969 г. В ней он подводит итог своим попыткам управлять движениями, вызывать воспоминания и иллюзии, доставлять удовольствие или причинять боль (см.: Хо-ган Д. Забытая эпоха электростимуляции мозга Ц ВМН, № 1, 2006). Книга завершается обсуждением того, какие последствия для медицины, этики, общества и даже армии вытекают из возможности управлять мозгом. После этого я уже не должен был бы удивиться тому, что на следующий день после публикации статьи у меня зазвонил телефон и один американский журналист спросил: «Ну и когда же наша армия мух с дистанционным управлением вторгнется в другую страну?»
Интерес средств массовой информации на этом не закончился. На следующий день в Drudge Report появился кричащий заголовок: «Ученые создают дистанционно управляемых насекомых», который даже оттеснил на второй план новости о последнем вызове в суд Майкла Джексона. Я думаю, что именно под влиянием заметки через неделю в Tonight Show появилась карикатура, на которой ведущий телепрограммы Джей Лино (Jay Leno) с помощью пульта дистанционного управления посылал муху прямо в рот президента Джорджа Буша — первое практическое применение нашей новой технологии.
С тех пор ученые уже смогли применить свет для управления и другими формами поведения. В октябре 2007 г. Диссерот и его коллега по Стэнфорду Луис де Лесеа (Luis de Lecea) объявили о результатах исследования на мышах, в котором они воспользовались оптическими волокнами для передачи света прямо к нейронам, производящим гипокретин (нейромедиатор, представляющий собой небольшую пептидную молекулу), чтобы таким образом проверить, действительно ли данные нейроны регулируют сон. В ходе работы было показано, что стимуляция гипокретинергических нейронов во время сна пробуждает животных, что подтверждает исходную гипотезу.
А в моей лаборатории в Йельском университете Дилан Клин (J. Dylan Clyne) воспользовался спусковыми устройствами, закодированными в генах, для того чтобы разобрать ся с межполовыми различиями в поведении.
Самцы многих видов животных тратят много сил и времени на ухаживание за самкой. У дрозофил самцы вибрируют одним крылышком, и это звучит как серенада, которую самки находят невероятно притягательной. Воспользовавшись светом, чтобы активировать генератор двигательных паттернов, ответственный за исполнение подобной песни, Клайн обнаружил, что самки обладают точно такими же нейронными сетями, необходимыми для исполнения серенады. Однако в нормальных условиях у них эти сети не получают пусковых нейронных сигналов. Данное открытие говорит о том, что мозг самцов и самок может иметь одно и то же устройство, а различия в поведении двух полов возникают из-за неких переключателей, располагающихся в стратегически важных местах и переключающих мозг в мужской или женский режим работы.
Светотерапия
До сих пор исследователи создавали животных, обладавших либо индикатором, либо спусковым устройством в интересующих их нейронах. Однако можно снабдить их и тем, и другим одновременно. Существует надежда, что когда-нибудь мы сможем даже создавать животных, имеющих сразу несколько индикаторов или спусковых устройств, что позволит нам одновременно изучать различные популяции нейронов на одном объекте.
Разработанные нами методы открывают огромные возможности для фундаментальных исследований. Сам Дельгадо назвал несколько областей, в которых прямое управление нервной системой может найти применение в клиниках: протезирование органов чувств, лечение нарушений двигательной сферы (сейчас это уже стало реальностью в виде стимуляции глубинных структур головного мозга при болезни Паркинсона), регуляция эмоционального состояния и поведения. Он видел в этом рациональное продолжение существующей медицинской практики, а вовсе не какое-то вторжение в разум другого человека, беспокоящее многих в этическом плане. И действительно, было бы нечестно проводить надуманную границу между физическими методами воздействия на мозг и химическими манипуляциями, будь то психотропные лекарства или же коктейль, помогающий вам расслабиться после трудного дня. Более того, физическое вмешательство можно направлять и дозировать более точно, чем лекарства, снижая тем самым возникновение побочных эффектов.
В некоторых исследованиях уже ведется поиск возможностей применения оптогенетики в медицине. В 2006 г. исследователи использовали активируемые светом ионные каналы для восстановления светочувствительности в нейронах сетчатки, сохранившихся после дегенерации фоторецепторов. Чтобы доставить ген, кодирующий каналородопсин-2, в клетки, они использовали вирус, который впрыскивали прямо в глаза животных. После такого «ремонта» сетчатка действительно начала в ответ на действие света посылать сигналы в мозг (хотя так и осталось не ясным, вернулось ли к мышам зрение).
Несмотря на огромный потенциал оптогенетики, имеется одно серьезное препятствие для ее применения на людях: она требует внедрения в мозг инородного гена, кодирующего управляемый светом «спусковой крючок». Однако сейчас о генной терапии даже не может идти и речи. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США настолько озабочено потенциальной рискованностью такой процедуры, что навсегда запретило подобное вмешательство — за исключением строго контролируемых экспериментальных целей.
Однако вполне реальная возможность, которую дают современные методы, состоит в выявлении новых мишеней для лекарств: если экспериментальные манипуляции с группами клеток X, YH Z зacтaвляют животное есть, спать или проявлять беспокойство, то, значит, X, У и Zсоответственно представляют собой
потенциальные мишени для препаратов против ожирения, бессонницы и тревожности. Обнаружение соединений, воздействующих на нейроны X, Y и Z, приведет к созданию новых или улучшению существующих лекарств, или же к тому, что для имеющихся лекарственных средств будет найдено новое применение. Еще очень многое нам только предстоит исследовать, однако будущее оптогенетики представляется мне в радужном свете.
Перевод: Б.В. Чернышев
ДОПОЛНИТЕЛЬНАЯ ЛИТЕРАТУРА
• Transmission of Olfactory Information between Three Populations of Neurons in the Antennal Lobe of the Fly. Minna Ng, Robert D. Roorda, Susana Q. Lima, Boris V. Zemelman, Patrick Morcillo and GeroMiesenbock in Neuron, Vol. 36, No. 3, pages 463-474; 2002.
• Remote Control of Behavior through Genetically Targeted Photostimulation of Neurons. Susana Q. Lima and GeroMiesenbock in Cell, Vol. 121, No. 1, pages 141-152; 2005.
• Neural Substrates of Awakening Probed with Optogenetic Control of Hypocretin Neurons. Antoine R. Adamantidis, Feng Zhang, Alexander M. Aravanis, Karl Deiseroth and Luis de Lecea in Nature, Vol. 450, pages 420-424; 2007.






 Издательство «Свиньин и сыновья» выпустило несколько сотен самых разных по жанру, объему и авторам, но неизменно высококультурных изданий
Издательство «Свиньин и сыновья» выпустило несколько сотен самых разных по жанру, объему и авторам, но неизменно высококультурных изданий





