Э. Нестлер, Р. Маленка. Мозг наркомана
Эрик Нестлер (Eric J. Nestler) и Роберт Маленка (Robert C. Malenka) изучают молекулярные механизмы наркотического привыкания. Нестлер - профессор и декан психиатрического факультета Юго-Западного медицинского центра Техасского университета в Далласе. Маленка - профессор психиатрии и этологии Медицинской школы Стэнфордского университета, бывший директор Центра нейробиологии наркотического привыкания Калифорнийского университета в Сан-Франциско.
Злоупотребление наркотиками вызывает стойкие изменения в различных отделах мозга. Понимание клеточных и молекулярных механизмов адаптации поможет разработать новые методы лечения наркомании.
Белые дорожки порошка. Шприц и ложка. Таблетки. Многих наркоманов один только вид наркотика или даже предметов, ассоциирующихся с ним, бросает в дрожь от предвкушаемого удовольствия. А после его приема наступает ни с чем не сравнимое блаженство: по телу разливается тепло, все проблемы исчезают, и кажется, что вся Вселенная лежит у ваших ног. Однако после неоднократного употребления наркотика начинает происходить нечто непонятное.
Человеку, чтобы вновь почувствовать себя окрыленным, необходимо понюхать, проглотить или вколоть препарат. Если этого не сделать, начинается депрессия, а часто и физическое недомогание, в том числе ломка. Но начальной дозы уже не хватает, и постепенно развивается зависимость, человек теряет контроль над собой и испытывает непреодолимую тягу к наркотику. Вскоре пагубное пристрастие начинает сказываться на здоровье, финансовом состоянии и личной жизни.
Нейробиологам давно известно, что эйфория, наступающая под влиянием наркотических веществ, связана с их стимулирующим действием на мозговую систему вознаграждения. Система представляет собой сложную сеть нервных клеток (нейронов), вызывающую чувство удовольствия после еды или занятий сексом, т.е. форм активности, необходимых для выживания и продолжения рода. Стимуляция системы вознаграждения доставляет наслаждение и побуждает снова и снова прибегать к тем формам активности, которые его обеспечили.
Однако последние исследования показали, что постоянный прием наркотиков вызывает структурные и функциональные изменения нейронов системы вознаграждения, сохраняющиеся недели, месяцы и даже годы после прекращения употребления препаратов. Таким образом, с одной стороны, адаптации ослабляют положительные эмоции, возникающие при приеме наркотика, с другой - они усиливают болезненную тягу человека к наркотическому веществу. Понимание молекулярных и клеточных механизмов действия наркотиков может привести к разработке новых методов лечения наркомании.
Смертельное пристрастие
Привыкание людей к различным наркотическим воздействиям опосредуется одними и теми же механизмами - к такому выводу ученые пришли в результате длительной экспериментальной работы, начавшейся 40 лет назад. Мыши, крысы и низшие приматы получали наркотические вещества, пользующиеся большой популярностью среди людей. Препараты животным вводились внутривенно. Когда наступало привыкание, их обучали нехитрой процедуре: чтобы получить инъекцию наркотика, грызуны должны были нажать на один рычаг, чтобы получить "неинтересную" инъекцию физиологического раствора - на другой, а корм - на третий. Через несколько дней животные с удовольствием вводили себе кокаин, героин, амфетамин и другие вещества.
Обнаружилось, что отдельные особи злоупотребляли наркотиками в ущерб жизненно важным формам активности - например, еде и сну. Некоторые даже погибали от истощения. Чтобы получить очередную дозу кокаина, грызуны были готовы сотни раз нажимать на рычаг. Кроме того, они отдавали явное предпочтение обстановке, ассоциирующейся с наркотиком: например, держались по преимуществу в той части клетки, где могли получить вожделенную дозу.
Если подача наркотика прекращалась, животное вскоре оставляло бесплодные попытки получить "химическое удовольствие". Но стоило крысе, в течение нескольких месяцев не получавшей кокаин, почуять его запах или даже оказаться в клетке, ассоциирующейся с наркотиком, она тут же начинала нажимать на заветный рычаг.
С помощью описанной методики внутривенного самовведения препаратов и некоторых других экспериментальных приемов исследователям удалось идентифицировать области головного мозга, ответственные за развитие наркотического привыкания. Ученые показали, что на мозговую систему вознаграждения наркотические вещества оказывают более сильное и глубокое стимулирующее действие, нежели какие-либо естественные факторы вознаграждения.
Ключевым звеном мозговой системы вознаграждения является сеть мезолимбических дофаминовых нейронов - нервных клеток, расположенных в вентральной области покрышки (ВОП) у основания мозга и посылающих проекции в различные отделы передней части мозга, главным образом в прилежащее ядро (nucleus accumbens). Нейроны ВОП высвобождают из терминалей аксонов нейротрансмиттер дофамин, связывающийся с соответствующими рецепторами нейронов прилежащего ядра. Дофаминовый нервный путь из ВОП в прилежащее ядро играет важную роль в развитии наркотического привыкания: животные с повреждением этих мозговых структур полностью утрачивают интерес к наркотикам.
Реостат вознаграждения
Система вознаграждения - эволюционно древнее образование мозга. У млекопитающих она устроена сложно и связана с областями мозга, придающими эмоциональную окраску ощущениям и направляющими поведение животных и человека на достижение вознаграждения - пищевого, полового, социального и т.д. Миндалина, к примеру, помогает определить, было ли ощущение приятным или неприятным, и сформировать связи между ним и прочими факторами окружающей среды. Гиппокамп принимает участие в формировании памяти о событии (ощущении) - где, когда и при каких обстоятельствах оно произошло (возникло). Лобные (фронтальные) области коры головного мозга перерабатывают и интегрируют всю эту информацию и определяют окончательное поведение особи. А путь ВОП-прилежащее ядро тем временем действует как реостат вознаграждения: он сообщает другим мозговым центрам, в какой степени активность особи способствует достижению вознаграждения. Чем выше эта оценка, тем больше вероятность того, что организм запомнит эту форму активности и повторит ее впоследствии.
Хотя основные представления о деятельности мозговой системы вознаграждения сложились в результате экспериментов на животных, исследования, проведенные за последние 10 лет методами нейровизуализации, показали, что аналогичные нервные структуры контролируют поведение, связанное с естественным или наркотическим вознаграждением, и у человека. С помощью магнитно-резонансной и позитронной эмиссионной томографии было установлено, что предложение понюхать кокаин вызывало у наркоманов рост нейронной активности в прилежащем ядре. Точно так же это ядро (а кроме него - миндалина и некоторые области коры) отреагировало и на демонстрацию испытуемым видеоклипа, где кокаин нюхали другие люди. А у заядлых игроков эти области мозга активизировались в ответ на предъявление фотографий игровых автоматов. Таким образом, можно предположить, что нервный путь ВОП-прилежащее ядро играет важную роль в развитии болезненного привыкания и ненаркотической зависимости.
Человеку, чтобы вновь почувствовать себя окрыленным, необходимо понюхать, проглотить или вколоть препарат. Если этого не сделать, начинается депрессия, а часто и физическое недомогание, в том числе ломка. Но начальной дозы уже не хватает, и постепенно развивается зависимость, человек теряет контроль над собой и испытывает непреодолимую тягу к наркотику. Вскоре пагубное пристрастие начинает сказываться на здоровье, финансовом состоянии и личной жизни.
Нейробиологам давно известно, что эйфория, наступающая под влиянием наркотических веществ, связана с их стимулирующим действием на мозговую систему вознаграждения. Система представляет собой сложную сеть нервных клеток (нейронов), вызывающую чувство удовольствия после еды или занятий сексом, т.е. форм активности, необходимых для выживания и продолжения рода. Стимуляция системы вознаграждения доставляет наслаждение и побуждает снова и снова прибегать к тем формам активности, которые его обеспечили.
Однако последние исследования показали, что постоянный прием наркотиков вызывает структурные и функциональные изменения нейронов системы вознаграждения, сохраняющиеся недели, месяцы и даже годы после прекращения употребления препаратов. Таким образом, с одной стороны, адаптации ослабляют положительные эмоции, возникающие при приеме наркотика, с другой - они усиливают болезненную тягу человека к наркотическому веществу. Понимание молекулярных и клеточных механизмов действия наркотиков может привести к разработке новых методов лечения наркомании.
Смертельное пристрастие
Привыкание людей к различным наркотическим воздействиям опосредуется одними и теми же механизмами - к такому выводу ученые пришли в результате длительной экспериментальной работы, начавшейся 40 лет назад. Мыши, крысы и низшие приматы получали наркотические вещества, пользующиеся большой популярностью среди людей. Препараты животным вводились внутривенно. Когда наступало привыкание, их обучали нехитрой процедуре: чтобы получить инъекцию наркотика, грызуны должны были нажать на один рычаг, чтобы получить "неинтересную" инъекцию физиологического раствора - на другой, а корм - на третий. Через несколько дней животные с удовольствием вводили себе кокаин, героин, амфетамин и другие вещества.
Обнаружилось, что отдельные особи злоупотребляли наркотиками в ущерб жизненно важным формам активности - например, еде и сну. Некоторые даже погибали от истощения. Чтобы получить очередную дозу кокаина, грызуны были готовы сотни раз нажимать на рычаг. Кроме того, они отдавали явное предпочтение обстановке, ассоциирующейся с наркотиком: например, держались по преимуществу в той части клетки, где могли получить вожделенную дозу.
Если подача наркотика прекращалась, животное вскоре оставляло бесплодные попытки получить "химическое удовольствие". Но стоило крысе, в течение нескольких месяцев не получавшей кокаин, почуять его запах или даже оказаться в клетке, ассоциирующейся с наркотиком, она тут же начинала нажимать на заветный рычаг.
С помощью описанной методики внутривенного самовведения препаратов и некоторых других экспериментальных приемов исследователям удалось идентифицировать области головного мозга, ответственные за развитие наркотического привыкания. Ученые показали, что на мозговую систему вознаграждения наркотические вещества оказывают более сильное и глубокое стимулирующее действие, нежели какие-либо естественные факторы вознаграждения.
Ключевым звеном мозговой системы вознаграждения является сеть мезолимбических дофаминовых нейронов - нервных клеток, расположенных в вентральной области покрышки (ВОП) у основания мозга и посылающих проекции в различные отделы передней части мозга, главным образом в прилежащее ядро (nucleus accumbens). Нейроны ВОП высвобождают из терминалей аксонов нейротрансмиттер дофамин, связывающийся с соответствующими рецепторами нейронов прилежащего ядра. Дофаминовый нервный путь из ВОП в прилежащее ядро играет важную роль в развитии наркотического привыкания: животные с повреждением этих мозговых структур полностью утрачивают интерес к наркотикам.
Реостат вознаграждения
Система вознаграждения - эволюционно древнее образование мозга. У млекопитающих она устроена сложно и связана с областями мозга, придающими эмоциональную окраску ощущениям и направляющими поведение животных и человека на достижение вознаграждения - пищевого, полового, социального и т.д. Миндалина, к примеру, помогает определить, было ли ощущение приятным или неприятным, и сформировать связи между ним и прочими факторами окружающей среды. Гиппокамп принимает участие в формировании памяти о событии (ощущении) - где, когда и при каких обстоятельствах оно произошло (возникло). Лобные (фронтальные) области коры головного мозга перерабатывают и интегрируют всю эту информацию и определяют окончательное поведение особи. А путь ВОП-прилежащее ядро тем временем действует как реостат вознаграждения: он сообщает другим мозговым центрам, в какой степени активность особи способствует достижению вознаграждения. Чем выше эта оценка, тем больше вероятность того, что организм запомнит эту форму активности и повторит ее впоследствии.
Хотя основные представления о деятельности мозговой системы вознаграждения сложились в результате экспериментов на животных, исследования, проведенные за последние 10 лет методами нейровизуализации, показали, что аналогичные нервные структуры контролируют поведение, связанное с естественным или наркотическим вознаграждением, и у человека. С помощью магнитно-резонансной и позитронной эмиссионной томографии было установлено, что предложение понюхать кокаин вызывало у наркоманов рост нейронной активности в прилежащем ядре. Точно так же это ядро (а кроме него - миндалина и некоторые области коры) отреагировало и на демонстрацию испытуемым видеоклипа, где кокаин нюхали другие люди. А у заядлых игроков эти области мозга активизировались в ответ на предъявление фотографий игровых автоматов. Таким образом, можно предположить, что нервный путь ВОП-прилежащее ядро играет важную роль в развитии болезненного привыкания и ненаркотической зависимости.
Участие дофамина
Почему на мозговую систему вознаграждения одинаково воздействуют кокаин, который, как известно, увеличивает частоту сердечного ритма, и героин, являющийся по сути дела обезболивающим седативным средством? Причина ясна: прием всех наркотиков вызывает усиленный приток дофамина (а иногда и сигналов, имитирующих его действие) к прилежащему ядру.
Когда нейроны ВОП возбуждаются, они посылают по своим аксонам электрические сигналы к прилежащему ядру. Те, в свою очередь, стимулируют высвобождение дофамина из кончиков аксона в крошечное пространство - синаптическую щель, разделяющую аксонную терминаль и нейрон прилежащего ядра. Здесь дофамин связывается соответствующими рецепторами в мембране нейронов прилежащего ядра, и сигнал поступает внутрь клетки. Когда сигналы нужно "выключить", нейрон ВОП удаляет избыток дофамина из синаптической щели и сохраняет его в аксоне до тех пор, пока вновь не возникнет необходимость послать сигнал нейронам прилежащего ядра.
Кокаин и прочие наркотики-стимуляторы на какое-то время выводят из строя белок, транспортирующий дофамин из синаптической щели в аксонную терминаль нейрона ВОП. Таким образом, в синаптической щели остается избыток дофамина, продолжающий действовать на нейроны прилежащего ядра. Героин и другие опиаты ведут себя иначе. Они связываются с нейронами ВОП, ответственными за "отключение" других нейронов этой же области - тех, что высвобождают дофамин. Последние начинают бесконтрольно изливать избыточное количество дофамина на нейроны прилежащего ядра. Кроме того, опиаты способны порождать мощный сигнал вознаграждения, непосредственно воздействуя на прилежащее ядро.
Однако действие наркотиков не ограничивается стимуляцией выброса дофамина, вызывающего эйфорию. Чтобы приспособиться к воздействию наркотиков, система вознаграждения постепенно изменяется - так возникает наркотическое привыкание.
СКАНОГРАММЫ МОЗГОВЫХ СТРУКТУР
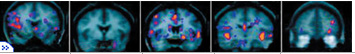
1 - Прилежащее ядро
2- Миндалина
3 - Сублентикулярная часть миндалины
4 - Вентральная область покрышки
5 - Префронтальная кора
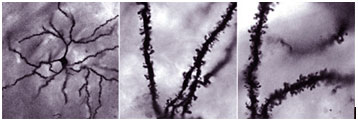
Микрофотографии прилежащего ядра животных, находящихся под воздействием ненаркотических веществ: дендриты с обычным количеством шипиков – выростов, улавливающих нервные сигналы (слева и в центре). У животных, пристрастившихся к кокаину, шипиков на дендритах гораздо больше (справа). Ученые предполагают, что подобные перестройки повышают чувствительность нейронов к сигналам из ВОП и других структур мозга и таким образом повышают чувствительность к наркотикам. Как показывают последние исследования, определенную роль в образовании дополнительных дендритных шипиков играет дельта-fosB.
Привыкание
На ранних стадиях потребления наркотиков у животных и людей развивается устойчивость к их действию (т.е. организм привыкает к дозе, и она не оказывает того действия, как раньше) и зависимость от них. Чтобы поднять настроение, наркоману каждый раз приходится незначительно увеличивать дозу препарата, что неизбежно порождает абстинентный синдром. Таким образом систематическое потребление наркотиков подавляет отдельные звенья мозговой системы вознаграждения.
В этом процессе участвует белок, связывающийся с cAMP-зависимым элементом (cAMP response element-binding protein, CREB). CREB представляет собой фактор транскрипции - белок, регулирующий экспрессию (активность) генов, а значит, и поведение нервных клеток в целом. Когда вводится наркотик, концентрация дофамина в прилежащем ядре повышается, что заставляет нервные клетки, чувствительные к нему, усиливать выработку циклического аденозинмонофосфата (сАМР) - вещества-посредника, активирующего CREB. Активированный CREB связывается со специфическими участками генов, инициируя синтез кодируемых ими белков. Но в подавлении мозговой системы вознаграждения участвует не только CREB. Через несколько дней после прекращения приема наркотика этот фактор транскрипции инактивируется. Поэтому действием CREB нельзя объяснить, например, изменения, заставляющие наркоманов возобновлять прием препаратов после многих лет и даже десятилетий воздержания. Рецидивы во многом обусловлены сенситизацией - усилением действия наркотиков.
Как ни парадоксально, но в отношении одного и того же препарата у человека и животного может развиваться как снижение восприимчивости организма к наркотику, так и сенситизация. Вскоре после приема наркотического вещества возрастает активность CREB и повышается устойчивость к его действию: в течение нескольких дней для стимуляции системы вознаграждения организму требуется все большее количество наркотического препарата. Но если его прием прекращается, активность CREB падает, в результате чего развивается сенситизация, порождающая потребность в наркотике. Неослабевающая тяга сохраняется даже после длительных периодов воздержания. Чтобы понять природу сенситизации, необходимо в первую очередь выяснить, какие молекулярные изменения могут сохраняться в течение периода, превышающего несколько дней. В голову тут же приходит мысль о другом факторе транскрипции - дельта-fosB.
Наркотический срыв
Дельта-fosB связан с развитием наркотического привыкания совсем иначе, нежели CREB. В опытах на мышах и крысах было установлено, что постоянное систематическое потребление наркотиков приводит к постепенному и стабильному увеличению концентрации этого белка в прилежащем ядре и других структурах головного мозга. Кроме того, поскольку дельта-fosB отличается необычайной устойчивостью, он остается активным в нейронах этих структур спустя недели и месяцы после приема препаратов. Такая активность вполне могла бы позволить белку поддерживать изменения в экспрессии генов еще долгое время после прекращения приема наркотиков.
Как показывают исследования мутантных мышей с чрезмерной выработкой дельта-fosB в прилежащем ядре, эти животные сверхчувствительны к наркотикам. Они с необычайной легкостью возобновляли прием препарата после его длительной отмены. Интересно отметить, что дельта-fosB вырабатывался у экспериментальных мышей и в ответ на повторные вознаграждения ненаркотической природы (например, быстрый бег в беличьем колесе или потребление сахара). Таким образом, вполне вероятно, что дельта-fosB принимает участие в развитии привыкания к гораздо более широкому спектру удовольствий, чем наркотические препараты.
Недавние исследования позволяют объяснить длительную сохранность сенситизации после возвращения концентрации дельта-fosB в норму. Известно, что постоянное систематическое воздействие кокаина и других наркотиков приводит к тому, что на дендритах нейронов прилежащего ядра образуются дополнительные шипики, с помощью которых клетка контактирует с другими нейронами. У грызунов этот процесс может продолжаться в течение нескольких месяцев после отмены наркотика. Можно предположить, что ответственность за образование дополнительных дендритных шипиков несет дельта-fosB.
Участие глутамата
До сих пор речь шла только об изменениях в мозговой системе вознаграждения, связанных с дофаминовым обменом. Однако в развитии наркотического привыкания принимают участие и другие структуры - миндалина, гиппокамп и лобная кора. Все они взаимодействуют с системой вознаграждения (ВОП и прилежащее ядро), высвобождая нейротрансмиттер глутамат. Как было установлено в опытах на животных, наркотики вызывают изменение чувствительности к глутамату системы вознаграждения, повышают как высвобождение дофамина из ВОП, так и чувствительность к дофамину прилежащего ядра. В результате увеличивается активность CREB и дельта-fosB.
Кратковременные стимулы определенного типа могут повышать реакции нейронов гиппокампа на глутамат. Феномен, получивший название долговременной потенциации, лежит в основе образования следа памяти и, по-видимому, опосредован перемещением некоторых рецепторов глутамата в мембраны нервных клеток, где они начинают реагировать на глутамат, высвобождаемый в синаптические щели. Наркотики влияют на включение глутаматных рецепторов в мозговую систему вознаграждения, а также воздействуют и на синтез некоторых из них.
В совокупности все эти изменения мозговой системы вознаграждения приводят к развитию устойчивой реакции организма на действие наркотических препаратов, зависимости от них и сложных форм поведения, связанных с их поиском. Многие аспекты этих сдвигов до сих пор остаются для ученых загадкой, но механизмы некоторых процессов изучены уже досконально. Во время длительного потребления наркотиков и в течение короткого времени после его прекращения отмечается изменение концентрации сАМР и активности CREB в мозговой системе вознаграждения. Это обусловливает рост толерантности к наркотику и зависимости от него и одновременное снижение восприимчивости человека к препарату, что ввергает наркомана в депрессию и апатию. Длительное воздержание от потребления наркотика приводит к изменению активности белка дельта-fosB и глутаматных систем мозга. Эти перемены повышают чувствительность наркомана к эффектам наркотика, когда по прошествии длительного времени он пробует его снова, и порождают у него сильные эмоциональные реакции как при воспоминаниях о былых наслаждениях, так и при воздействии внешних факторов, воскрешающих эти воспоминания.
Общие терапевтические подходы
Понимание молекулярных механизмов, стоящих за развитием наркотического привыкания, открывает новые перспективы для медикаментозной терапии. Злоупотребление наркотиками наносит серьезный вред физическому и психическому состоянию людей и служит одной из главных причин заболеваний внутренних органов. Среди алкоголиков очень высок риск цирроза печени, среди курильщиков - рака легких, среди наркоманов, пользующихся общими шприцами, - СПИДа. Экономический ущерб от злоупотребления наркотическими веществами в США ежегодно составляет более $ 300 млрд. Если же расширить понятие "наркомания" и включить в него другие формы патологически навязчивого поведения (например, обжорство и азартные игры), эта цифра станет неизмеримо выше. Таким образом, разработка терапевтических подходов, способных корректировать аномальные реакции людей на стимулы-вознаграждения (будь то кокаин, пирожные или игровой автомат), могла бы принести обществу огромную пользу.
Лечение наркомании современными методами в большинстве случаев оказывается неэффективным. Существуют лекарства, не позволяющие наркотику достичь соответствующей структуры мозга, однако они не вызывают ни нормализации мозгового биохимизма пациента, ни ослабления его тяги к наркотику. Другие препараты имитируют эффекты наркотиков и, ослабляя тягу к ним человека, дают ему время отвыкнуть от пагубного пристрастия. Но их использование чревато тем, что пациент попросту может поменять одну привычку на другую. Хотя многим помогают немедикаментозные реабилитационные программы. Однако значительный процент их участников через какое-то время возобновляет прием наркотиков.
Раскрыв биологические механизмы наркотического привыкания, исследователи, возможно, преуспеют в создании лекарств нового поколения. Вырвать человека из смертоносных объятий наркотиков помогут соединения, способные специфически реагировать с рецепторами глутамата или дофамина в прилежащем ядре, или вещества, мешающие CREB или дельта-fosB воздействовать на соответствующие гены в этой структуре головного мозга.
Кроме того, необходимо научиться распознавать людей, склонных к злоупотреблению наркотиками. Хотя в развитии этой привычки огромную роль играют психологические, эмоциональные, социальные и средовые факторы, статистические исследования показывают, что риск пристраститься к наркотику на 50% обусловлен генами. Эти гены пока не идентифицированы, но если ученые научатся диагностировать наркотическую предрасположенность в раннем возрасте, людям, входящим в группу риска, может быть оказана своевременная помощь.
Если учесть все обстоятельства, вряд ли когда-либо появятся лекарства, способные обеспечить полное лечение этого синдрома. Однако можно надеяться, что новые терапевтические подходы позволят хотя бы ослабить его биологическую составляющую (наркотическую зависимость) и откроют новые возможности для физической и психической реабилитации больных психо-социальными методами.
Привыкание
На ранних стадиях потребления наркотиков у животных и людей развивается устойчивость к их действию (т.е. организм привыкает к дозе, и она не оказывает того действия, как раньше) и зависимость от них. Чтобы поднять настроение, наркоману каждый раз приходится незначительно увеличивать дозу препарата, что неизбежно порождает абстинентный синдром. Таким образом систематическое потребление наркотиков подавляет отдельные звенья мозговой системы вознаграждения.
В этом процессе участвует белок, связывающийся с cAMP-зависимым элементом (cAMP response element-binding protein, CREB). CREB представляет собой фактор транскрипции - белок, регулирующий экспрессию (активность) генов, а значит, и поведение нервных клеток в целом. Когда вводится наркотик, концентрация дофамина в прилежащем ядре повышается, что заставляет нервные клетки, чувствительные к нему, усиливать выработку циклического аденозинмонофосфата (сАМР) - вещества-посредника, активирующего CREB. Активированный CREB связывается со специфическими участками генов, инициируя синтез кодируемых ими белков. Но в подавлении мозговой системы вознаграждения участвует не только CREB. Через несколько дней после прекращения приема наркотика этот фактор транскрипции инактивируется. Поэтому действием CREB нельзя объяснить, например, изменения, заставляющие наркоманов возобновлять прием препаратов после многих лет и даже десятилетий воздержания. Рецидивы во многом обусловлены сенситизацией - усилением действия наркотиков.
Как ни парадоксально, но в отношении одного и того же препарата у человека и животного может развиваться как снижение восприимчивости организма к наркотику, так и сенситизация. Вскоре после приема наркотического вещества возрастает активность CREB и повышается устойчивость к его действию: в течение нескольких дней для стимуляции системы вознаграждения организму требуется все большее количество наркотического препарата. Но если его прием прекращается, активность CREB падает, в результате чего развивается сенситизация, порождающая потребность в наркотике. Неослабевающая тяга сохраняется даже после длительных периодов воздержания. Чтобы понять природу сенситизации, необходимо в первую очередь выяснить, какие молекулярные изменения могут сохраняться в течение периода, превышающего несколько дней. В голову тут же приходит мысль о другом факторе транскрипции - дельта-fosB.
Наркотический срыв
Дельта-fosB связан с развитием наркотического привыкания совсем иначе, нежели CREB. В опытах на мышах и крысах было установлено, что постоянное систематическое потребление наркотиков приводит к постепенному и стабильному увеличению концентрации этого белка в прилежащем ядре и других структурах головного мозга. Кроме того, поскольку дельта-fosB отличается необычайной устойчивостью, он остается активным в нейронах этих структур спустя недели и месяцы после приема препаратов. Такая активность вполне могла бы позволить белку поддерживать изменения в экспрессии генов еще долгое время после прекращения приема наркотиков.
Как показывают исследования мутантных мышей с чрезмерной выработкой дельта-fosB в прилежащем ядре, эти животные сверхчувствительны к наркотикам. Они с необычайной легкостью возобновляли прием препарата после его длительной отмены. Интересно отметить, что дельта-fosB вырабатывался у экспериментальных мышей и в ответ на повторные вознаграждения ненаркотической природы (например, быстрый бег в беличьем колесе или потребление сахара). Таким образом, вполне вероятно, что дельта-fosB принимает участие в развитии привыкания к гораздо более широкому спектру удовольствий, чем наркотические препараты.
Недавние исследования позволяют объяснить длительную сохранность сенситизации после возвращения концентрации дельта-fosB в норму. Известно, что постоянное систематическое воздействие кокаина и других наркотиков приводит к тому, что на дендритах нейронов прилежащего ядра образуются дополнительные шипики, с помощью которых клетка контактирует с другими нейронами. У грызунов этот процесс может продолжаться в течение нескольких месяцев после отмены наркотика. Можно предположить, что ответственность за образование дополнительных дендритных шипиков несет дельта-fosB.
Участие глутамата
До сих пор речь шла только об изменениях в мозговой системе вознаграждения, связанных с дофаминовым обменом. Однако в развитии наркотического привыкания принимают участие и другие структуры - миндалина, гиппокамп и лобная кора. Все они взаимодействуют с системой вознаграждения (ВОП и прилежащее ядро), высвобождая нейротрансмиттер глутамат. Как было установлено в опытах на животных, наркотики вызывают изменение чувствительности к глутамату системы вознаграждения, повышают как высвобождение дофамина из ВОП, так и чувствительность к дофамину прилежащего ядра. В результате увеличивается активность CREB и дельта-fosB.
Кратковременные стимулы определенного типа могут повышать реакции нейронов гиппокампа на глутамат. Феномен, получивший название долговременной потенциации, лежит в основе образования следа памяти и, по-видимому, опосредован перемещением некоторых рецепторов глутамата в мембраны нервных клеток, где они начинают реагировать на глутамат, высвобождаемый в синаптические щели. Наркотики влияют на включение глутаматных рецепторов в мозговую систему вознаграждения, а также воздействуют и на синтез некоторых из них.
В совокупности все эти изменения мозговой системы вознаграждения приводят к развитию устойчивой реакции организма на действие наркотических препаратов, зависимости от них и сложных форм поведения, связанных с их поиском. Многие аспекты этих сдвигов до сих пор остаются для ученых загадкой, но механизмы некоторых процессов изучены уже досконально. Во время длительного потребления наркотиков и в течение короткого времени после его прекращения отмечается изменение концентрации сАМР и активности CREB в мозговой системе вознаграждения. Это обусловливает рост толерантности к наркотику и зависимости от него и одновременное снижение восприимчивости человека к препарату, что ввергает наркомана в депрессию и апатию. Длительное воздержание от потребления наркотика приводит к изменению активности белка дельта-fosB и глутаматных систем мозга. Эти перемены повышают чувствительность наркомана к эффектам наркотика, когда по прошествии длительного времени он пробует его снова, и порождают у него сильные эмоциональные реакции как при воспоминаниях о былых наслаждениях, так и при воздействии внешних факторов, воскрешающих эти воспоминания.
Общие терапевтические подходы
Понимание молекулярных механизмов, стоящих за развитием наркотического привыкания, открывает новые перспективы для медикаментозной терапии. Злоупотребление наркотиками наносит серьезный вред физическому и психическому состоянию людей и служит одной из главных причин заболеваний внутренних органов. Среди алкоголиков очень высок риск цирроза печени, среди курильщиков - рака легких, среди наркоманов, пользующихся общими шприцами, - СПИДа. Экономический ущерб от злоупотребления наркотическими веществами в США ежегодно составляет более $ 300 млрд. Если же расширить понятие "наркомания" и включить в него другие формы патологически навязчивого поведения (например, обжорство и азартные игры), эта цифра станет неизмеримо выше. Таким образом, разработка терапевтических подходов, способных корректировать аномальные реакции людей на стимулы-вознаграждения (будь то кокаин, пирожные или игровой автомат), могла бы принести обществу огромную пользу.
Лечение наркомании современными методами в большинстве случаев оказывается неэффективным. Существуют лекарства, не позволяющие наркотику достичь соответствующей структуры мозга, однако они не вызывают ни нормализации мозгового биохимизма пациента, ни ослабления его тяги к наркотику. Другие препараты имитируют эффекты наркотиков и, ослабляя тягу к ним человека, дают ему время отвыкнуть от пагубного пристрастия. Но их использование чревато тем, что пациент попросту может поменять одну привычку на другую. Хотя многим помогают немедикаментозные реабилитационные программы. Однако значительный процент их участников через какое-то время возобновляет прием наркотиков.
Раскрыв биологические механизмы наркотического привыкания, исследователи, возможно, преуспеют в создании лекарств нового поколения. Вырвать человека из смертоносных объятий наркотиков помогут соединения, способные специфически реагировать с рецепторами глутамата или дофамина в прилежащем ядре, или вещества, мешающие CREB или дельта-fosB воздействовать на соответствующие гены в этой структуре головного мозга.
Кроме того, необходимо научиться распознавать людей, склонных к злоупотреблению наркотиками. Хотя в развитии этой привычки огромную роль играют психологические, эмоциональные, социальные и средовые факторы, статистические исследования показывают, что риск пристраститься к наркотику на 50% обусловлен генами. Эти гены пока не идентифицированы, но если ученые научатся диагностировать наркотическую предрасположенность в раннем возрасте, людям, входящим в группу риска, может быть оказана своевременная помощь.
Если учесть все обстоятельства, вряд ли когда-либо появятся лекарства, способные обеспечить полное лечение этого синдрома. Однако можно надеяться, что новые терапевтические подходы позволят хотя бы ослабить его биологическую составляющую (наркотическую зависимость) и откроют новые возможности для физической и психической реабилитации больных психо-социальными методами.






 Издательство «Свиньин и сыновья» выпустило несколько сотен самых разных по жанру, объему и авторам, но неизменно высококультурных изданий
Издательство «Свиньин и сыновья» выпустило несколько сотен самых разных по жанру, объему и авторам, но неизменно высококультурных изданий





